Enlace Iónico: Es cuando hay transferencia completa de un átomo a otro. El átomo que pierde electrones se convierte en un ión positivo o catión, y el que gana se convierte en ión negativo o catión. Es más común encontrar enlaces covalentes entre los elementos de los primeros tres grupos. Cuando un átomo pierde electrones se dice que se oxida, y cuando gana se dice que se reduce.

Enlace Covalente: Es cuando los átomos que se combinan comparten electrones. Se forma con facilidad entre átomos semejantes. El hidrógeno siempre forma enlaces covalentes. Hay diversos tipos de enlaces covalentes:

Polar: Entre dos elementos distintos Si**C
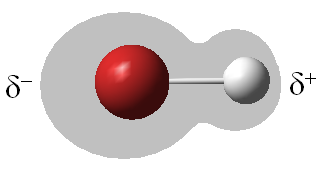
No Polar: Entre elementos iguales C**C

Coordinado: El enlace se forma con dos electrones del mismo átomo
Sencillo: Comparten un par de electrones
Doble: Comparten dos pares de electrones
Triple: Comparten tres pares de electrones
Electronegatividad: Es una medida de la tendencia que muestra un átomo de in enlace covalente de atraer hacia sí los electrones compartidos.
Estructura de Lewis: Es una representación de una molécula, en donde solo se indican los electrones de valencia de los átomos. Se utiliza un guión para representar un enlace covalente, y puntos para los electrones no compartidos.
No hay comentarios:
Publicar un comentario